Méningo-encéphalite d'origine indéterminée chez le chien : les avancées du protocole cytosine-arabinoside
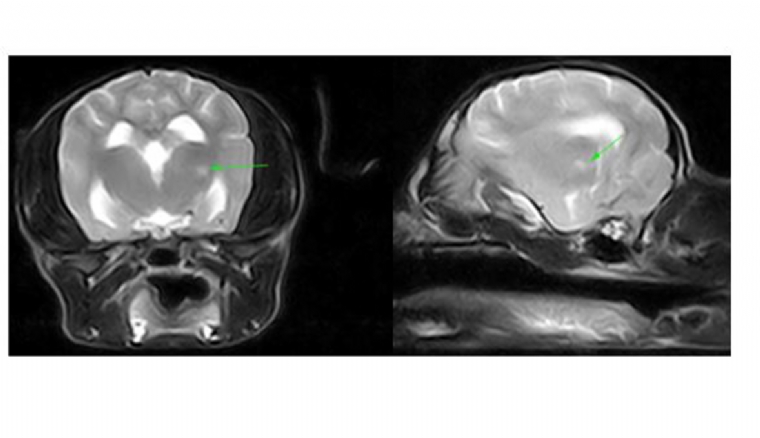
Coupes transverse et sagittale T2. Cette imagerie a révélé chez Moustic une infiltration focale du lobe thalamique gauche avec rehaussement méningé.
© CHV Languedocia
Adrien PRIVAT
Interne en médecine des
animaux de compagnie
Centre hospitalier vétérinaire Languedocia (34)
Stéphanie PIAZZA
Spécialiste en neurologie
vétérinaire
Centre hospitalier vétérinaire Languedocia (34)
Neurologie
Les méningo-encéphalites d'origine indéterminée sont un réel challenge diagnostique et thérapeutique. La présentation clinique est très variable, nécessite un examen nerveux rigoureux et des examens complémentaires parfois peu accessibles. Face au nombre de cas important, les études sur le sujet sont nombreuses ces dernières années et ciblent, notamment, différents protocoles thérapeutiques qui semblent offrir des pronostics plus favorables.
L'objectif de cet article est de décrire un cas de méningoencéphalite chez un chien et d'aborder la nouvelle voie d'administration intra-veineuse (IV) du protocole cytosine-arabinoside.
Anamnèse
Moustic est un chihuahua mâle entier de 1 an et 4 mois, adopté chiot, correctement vacciné et vermifugé, sans antécédent particulier.
Deux semaines avant la présentation, une démarche « en crabe » a été remarquée par la propriétaire.
Un traitement anti-inflammatoire (méloxicam) a été prescrit lors d'une consultation d'urgence, sans amélioration de la démarche et avec quelques effets secondaires (vomissements répondant aux traitements symptomatiques).
La démarche s'est progressivement aggravée avec le temps et des gémissements ainsi qu'une démarche en cercle sont apparus.
Examen clinique
L'examen général est sans particularité.
L'examen nerveux est le suivant :
- état mental et comportement : normaux ;
- posture : pleurotonus (corps incurvé) à gauche ;
- démarche : ambulatoire, ataxie mixte des quatre membres à tendance hypermétrique, parésie plus marquée sur le bipède gauche ;
- réactions posturales : placers proprioceptifs absents sur le bipède gauche ;
- réflexes médullaires : normaux sur les quatre membres ;
- douleur : pas de douleur à la palpation cervicale et thoracolombaire ;
- nerfs crâniens : tête discrètement penchée à gauche, autre réflexes et réponses normales.
Concernant la localisation neuro-anatomique, l'examen nerveux nous amène à suspecter une atteinte encéphalique multifocale (prosencéphale et/ou tronc cérébral), plus ou moins associée à une atteinte de la moelle épinière cervicale.
Hypothèses diagnostiques
Les données épidémiologiques, l'anamnèse et la localisation neuro-anatomique mènent à établir la liste des hypothèses les plus probables chez ce chien (voir tableau n° 1).
Examens complémentaires
Un bilan pré-anesthésique comprenant une numération et formule sanguine et une biochimie de base n'a pas montré d'anomalie, exceptée une discrète leucocytose neutrophilique.
L'exploration de lésion intracrânienne nécessite le recours à de l'imagerie en coupe, préférentiellement l'imagerie par résonnance magnétique (IRM).
Cette imagerie a révélé une infiltration focale du lobe thalamique gauche avec rehaussement méningé.
Une lésion intramédullaire cervicale était également présente et compatible avec une cavité liquidienne (syringohydromyélie). Une ponction et une analyse du liquide cérébrospinal ont été réalisées par ponction lombaire, compte tenu de la malformation anatomique de la région occipito-atlanto axiale, fréquente dans cette race et contre-indiquant une ponction par voie cisternale.
Cette analyse a révélé une pléiocytose avec 20 cellules nuclées/µl (la concentration normale étant inférieure à 5 cellules/µl) et une estimation de la protéinorachie à deux croix sur une bandelette urinaire.
Un différentiel cellulaire n'a pas été possible pour des raisons logistiques (examens réalisés un week-end et le liquide cérébro-spinal, ou LCS, ne se conservant pas). Des sérologies (IgG et IgM) toxoplasmose et néosporose ont été envoyées.
Diagnostic
Compte tenu des éléments épidémiologiques, anamnestiques et des résultats des examens d'imagerie et d'analyse du LCS, une méningo-encéphalite d'origine indéterminée est l'hypothèse la plus probable, une origine infectieuse ou néoplasique étant nettement moins probable.
Prise en charge de Moustic
En attendant les résultats des sérologies, une injection de dexaméthasone à la dose de 0,2 mg/kg IV puis un relais avec de la prednisolone à la dose de 0,5 mg/kg deux fois par jour (bis in die ou BID) et de la clindamycine à la dose de 12,5 mg /kg BID ont été mis en place, en plus d'une perfusion d'entretien, d'une surveillance de l'examen clinique et nerveux et de soins de nursing.
Dès réception des résultats des sérologies - qui étaient négatives - une perfusion continue IV de cytosine arabinosine à 200 mg/m2 sur 12 heures a alors été mise en place, en plus d'une augmentation de la prednisolone à 1 mg/kg BID et de l'arrêt de la clindamycine.
L'état de Moustic s'est d'abord stabilisé les premières 48 heures (plus d'aggravation clinique), pour ensuite s'améliorer. Une sortie a été décidée 5 jours après son admission, avec un plan de dimi nution très progressif de la prednisolone (sur 6 mois) et la recommandation de poursuivre les protocoles cytarabine toutes les 3 semaines.
Suivi
Moustic est revu toutes les 3 semaines pour un protocole d'injection de cytarabine à raison de quatre injections de 100 mg/m2 chacune, à 12 heures d'intervalle, pendant 48 heures.
Une numération et formule sanguine a été réalisée avant le second protocole et ne montrait pas d'anomalie. Son examen général et nerveux étaient normaux dès la 2e séance (voir tableau n° 2).
Au contrôle à trois semaines, l'examen nerveux était normal. Moustic est alors considéré en rémission clinique. Lors du contrôle à 18 semaines, l'IRM montrait une très discrète persistance d'une zone ponctiforme hyper-intense en T2, à l'endroit de la lésion décrite précédemment.
Cette lésion pouvait représenter soit une lésion moindre mais néanmoins toujours active, soit une lésion cicatricielle. Une décision de stopper les séances de cytarabine et de poursuivre la diminution de la prednisolone a été prise.
Lors du second contrôle IRM à 48 semaines, plus aucune lésion n'était visible. Moustic est alors considéré en rémission clinique et biologique.
Il a été revu en contrôle clinique à 2 ans (soit 1 an et 3 mois après l'arrêt de tout traitement) et aucun signe de récidive n'a été mis en évidence. A ce stade, une guérison est envisagée.
Le cas de Moustic permet d'ouvrir une discussion sur les méningo-encéphalites d'origine indéterminée (MOI) et le traitement à base de cytosine-arabinoside par voie IV.
Définition et
épidémiologie
Les méningo-encéphalites sont les atteintes inflammatoires de l'encéphale. Elles peuvent avoir trois origines : une origine infectieuse (toxoplasmose, néosporose, maladie de Carré, cryptococcose, leishmaniose, etc.), une origine non infectieuse ou une origine néoplasique.
Les MOI regroupent l'ensemble des atteintes inflammatoires non infectieuses, que l'on suspecte être à médiation immune. Ce terme englobe plusieurs entités : la méningo-encéphalite granulomateuse (MEG), la méningo-encéphalite nécrosante (MEN), la leuco-encéphalite nécrosante (LEN), etc. Certains critères (signalement, IRM...) permettent d'orienter vers une atteinte en particulier mais le diagnostic définitif repose sur l'histologie, souvent non accessible in vivo. C'est pourquoi on les regroupe sous le terme MOI. Dans les pays à faible prévalence de maladie de Carré, les MOI sont les causes de méningoencéphalites les plus fréquentes.
Bien que toutes les races puissent être atteintes, il existe une forte prédisposition pour les animaux de petite race et de race miniature (Yorkshire terriers, chihuahuas, bouledogues français, bichons maltais...).
Les jeunes adultes sont beaucoup plus fréquemment atteints. Une prévalence supérieure chez les femelles est décrite mais controversée.
Présentation clinique
La présentation clinique est celle d'une atteinte du système nerveux central, souvent multifocale.
Elle peut être très variable selon la gravité et la localisation des lésions (crises d'épilepsie, anomalie de l'état d'éveil ou du comportement, ataxie, parésie, déficits des réactions posturales, syndrome vestibulaire, syndrome cérébelleux...).
Les signes systémiques et biologiques sont possibles mais rares (fièvre, leucocytose neutrophilique...).
La survenue et l'évolution des signes cliniques est souvent aiguë mais des évolutions chroniques sont possible.
L'étiologie exacte reste, pour le moment, inconnue. Il semblerait qu'un mécanisme dysimmunitaire soit à l'origine de ces MOI, ce que semble aussi suggérer la réponse positive aux traitements immunosuppresseurs.
Un élément déclencheur (agent infectieux, facteur environnemental...) serait peut-être à l'origine d'une réaction immunitaire inappropriée. Cependant, la physiopathogénie est probablement multifactorielle, avec l'implication de certains facteurs génétiques.
Diagnostic
Le diagnostic de MOI se base donc sur le recoupement d'informations venant du signalement, de l'examen nerveux et du résultat des examens complémentaires.
Après un examen nerveux rigoureux et une neuro-localisation des lésions à l'encéphale, les examens de choix sont l'imagerie en coupe et l'analyse de LCS (si celle-ci n'est pas contre-indiquée par les examens d'imagerie).
Il est à noter que le scanner, s'il peut, dans certains cas, révéler des anomalies compatibles avec un processus inflammatoire, peut aussi s'avérer complètement normal alors que des lésions sévères sont présentes et visibles sur une IRM.
Le scanner ne permet donc en aucun cas d'exclure une méningo-encéphalite. Même si l'IRM peut parfois être également normale, elle apporte un degré de confiance bien supérieur.
Chez les patients atteints de MOI, le LCS est souvent inflammatoire. Cependant, lors de certaines atteintes parenchymateuses profondes, le LCS peut être tout à fait normal. Une ponction de LCS normale ne permet donc pas d'exclure une MOI. C'est pourquoi, si les examens d'imagerie et la ponction de LCS sont les examens de choix, leurs résultats doivent être corrélés aux éléments épidémiologiques, à l'anamnèse et à l'examen clinique.
Traitement
Le traitement de ces maladies est immunosuppresseur. Les corticoïdes sont le traitement de base mais l'ajout d'un second agent immunomodulateur montre un bénéfice réel sur les chances de rémission, voire de guérison, des animaux atteints de MOI.
Le traitement doit être mis en place rapidement car les études montrent une mortalité très forte dans les premiers jours.
Cependant, passée la période critique initiale, un traitement à long terme adapté offre généralement une rémission clinique (totale ou partielle) sur le long terme.
Les glucocorticoïdes
En pratique, il est recommandé de commencer les corticoïdes (prednisolone) à doses anti-inflammatoires (0,5mg/kg) en attendant les résultats de laboratoire permettant d'exclure les origines infectieuses.
Une fois ces résultats reçus, la dose est augmentée à 1, voire 2 mg/kg BID. Sur les animaux critiques dont la suspicion de MOI est forte, le traitement immunosuppresseur est parfois mis en place avant la réception de ces résultats.
Lorsque l'atteinte commence à être contrôlée, la dose de prednisolone est très progressivement diminuée sur plusieurs mois.
Les agents immunomodulateurs
De nombreux agents immunosuppresseurs ont été décrits pour être utilisés en association avec la prednisolone comme traitement des MOI. Il s'agit de la cytosine arabinoside, la cyclosporine, l'azathioprine, la procarbazine, la lomustine, la vincristine, leflunomide et le mycophenolate mofetil.
Les médianes de survie et la qualité de vie semblent nettement améliorées lorsqu'ils sont utilisés en association avec les glucocorticoïdes mais, les agents immunosuppresseurs étant nombreux, les protocoles et les mesures de recrutement utilisés étant très variables selon les auteurs, la comparaison de l'efficacité de ces différents traitements est délicate.
Bien qu'une comparaison objective soit impossible, en l'état actuel des connaissances, les dernières publications semblent s'accorder pour mettre en avant la cytosine-arabinoside.
La cytosine-arabinoside, un immunosupresseur de choix
Depuis une quinzaine d'années, la cytosine-arabinoside s'impose comme un traitement de choix de la MOI. Il s'agit d'un agent cytotoxique qui franchit la barrière hémato-méningée. Dès 2006, des études montraient l'efficacité, l'innocuité ainsi que des rémissions à long terme avec une molécule assez peu onéreuse.
En accord avec la pharmacocinétique, une étude récente et prometteuse évalue l'administration de cytosine-arabinoside par perfusion IV.
Le protocole décrit dans la littérature utilise une perfusion continue (CRI) de cytosine arabinoside 100 mg/m2 sur les premières 24 heures du traitement. La suite du traitement se fait de manière identique au protocole qui était utilisé jusque-là (50 mg/m2 par voie sous-cutanée BID pendant
48 heures, toutes les trois semaines). L'étude comparative entre ces deux protocoles montre l'efficacité, l'innocuité ainsi que sa supériorité par rapport à la voie sous-cutanée (SC) dès l'initiation du traitement.
Cette étude, menée sur 80 chiens a montré un taux de survie, à 3 mois, de 44 % pour le groupe SC et de 90 % pour le groupe IV.
De plus, les résultats des examens de contrôle sont aussi significativement différents : à 3 mois post-initiation du traitement, le LCS était normal chez 97,3 % des chiens traités avec le protocole IV, alors qu'il n'était que de 58,8 % chez les chiens avec l'administration SC. Les images IRM étaient normales chez 92 % des patients alors qu'elles ne l'étaient qu'a 41 % pour le protocole SC.
La différence est fortement significative et montre un réel intérêt de la voie IV. Enfin, ce protocole semble aussi sécuritaire avec de très faibles effets secondaires.
Le suivi et l'importance des contrôles
Le succès thérapeutique est évalué par la réponse clinique et la résolution des déficits nerveux. Les analyses de LCS et les images IRM de contrôle sont cependant primordiales pour évaluer l'évolution des lésions, adapter le traitement et prévenir les récidives.
Conclusion
Les méningoencéphalites d'origine indéterminées sont un vrai challenge diagnostique et thérapeutique. Si aucun traitement n'est mis en place, elles sont le plus souvent considérées comme fatales.
Le traitement immunosuppresseur à mettre en place doit idéalement associer prednisolone et un second immunomodulateur.
La cytosine arabinosine est une option prometteuse et notamment par voie IV lors de l'initiation du traitement (une phase critique ou le taux de mortalité est élevé). ■
Cet article a été réalisé dans le cadre du programme de l'Internship des Centres hospitaliers vétérinaires avec le partenariat de Boehringer Ingelheim, Zoetis, Hill's et Santévet.
La bibliographie est consultable sur demande à l'adresse : depecheveterinaire@depecheveterinaire.com