Dysfonctionnement cardiaque et alimentation
Samedi 15 Fevrier 2025 Focus 52508© Kahina Kartout
Kahina Kartout
Vétérinaire, praticienne en cardiologie à la clinique vétérinaire Roland Garros (92), CEAV en Médecine Interne (Vetagro Sup), DU cardiologie pédiatrique (Université Paris/Necker)
Longtemps négligée, la question du régime alimentaire inadapté des animaux domestiques gagne désormais en importance en médecine vétérinaire. Le domaine de la cardiologie vétérinaire est également concerné par cette problématique avec la mise en évidence d'un lien entre la consommation d'aliments non traditionnels et la survenue d'une dysfonction myocardique chez le chien.
Admission
Anamnèse et Commémoratifs
Une chienne stérilisée, American Staffordshire Terrier, âgée de 4 ans et pesant 19,5 kg, est référée en cardiologie pour exploration d'un souffle cardiaque de découverte fortuite. La chienne est nourrie depuis deux ans avec un aliment étiqueté sans céréales (croquettes non vétérinaires) de la marque ACANA. Cet aliment a pour particularité d'être riche en légumineuses (petits pois entiers, lentilles et pois chiches entiers), de ne pas être supplémenté en taurine et de contenir une seule source de protéine animale à base d'agneau. La chienne ne présente aucun autre antécédent médical notable, hormis une perte de poids progressive en l'espace des 8 derniers mois estimée à 13,7 % de son poids corporel malgré un appétit conservé.
Examen clinique à l'admission
L'animal est en bon état général. Son score corporel est de 4/9, et l'inspection, comme la palpation, ne révèlent aucune anomalie. L'auscultation cardiaque met en évidence une tachycardie régulière, avec une fréquence cardiaque (FC) égale à 140 battements par minute (bpm), et confirme la présence d'un souffle systolique apexien gauche (SSAG) piaulant de haut grade (4/6) avec une prolongation diastolique.
Examen échocardiographique à l'admission
Un examen échocardiographique et Doppler est réalisé en première intention et permet de mettre en évidence deux anomalies chez cette chienne, à savoir un phénotype « myocardiopathie dilatée (MCD) », associé à une dysplasie mitrale sténosante.
Le phénotype MCD est caractérisé par une altération marquée de la fonction systolique ventriculaire gauche (Vidéos 1 et 2), comme en témoignent les paramètres échocardiographiques suivants :
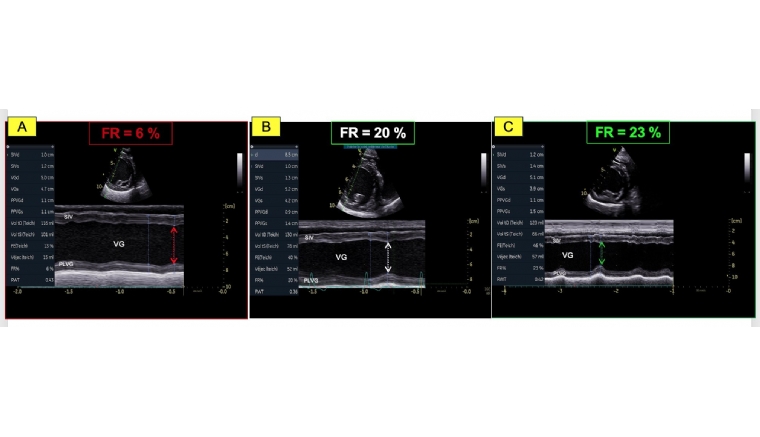
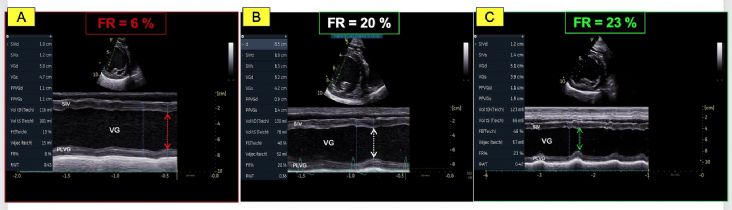
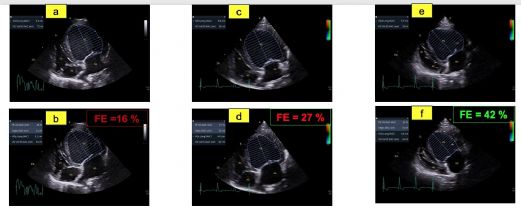
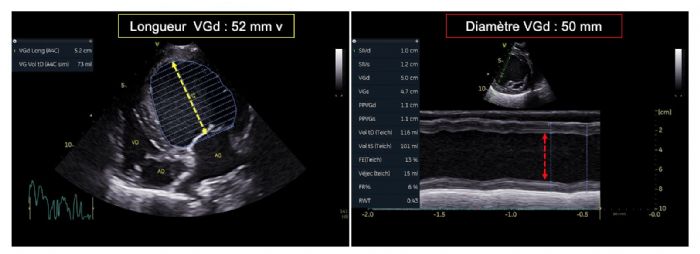
- La valeur très diminuée de la fraction de raccourcissement (FR) égale à 6 %; (valeurs usuelles (VU) 29%) (Figure 1A) ainsi que de la fraction d'éjection (FE) ventriculaire gauche égale à 16% ; (VU 42%) (Figures 2A et 2B) ;
- L'hypokinésie septale très marquée, associée à une dilatation très importante systolo-diastolique ventriculaire gauche, confirmée par l'indexation du diamètre et des volumes ventriculaires gauches au poids corporel1 ;
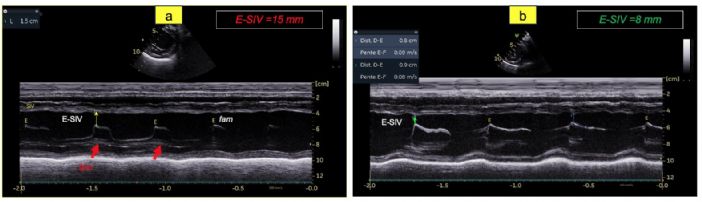
- La nette augmentation de la distance entre l'onde E mitrale et le septum interventriculaire (E-SIV) égale à 15 mm (VU chiens sains 7,7 mm) (Figure 3A) ;
- La diminution de l'indice de sphéricité égale à 1,04 ; (Valeur seuil 1,65 selon Dukes-McEwan et coll., 20032) (Figure 4) ;
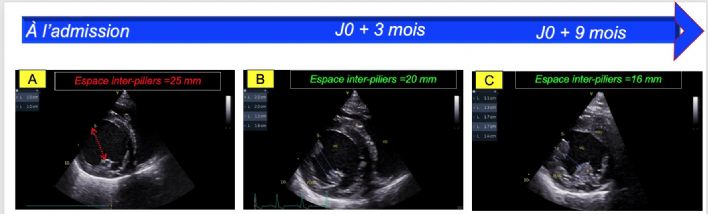
- L'élargissement de l'espace inter-piliers déterminé sur la coupe transventriculaire obtenue par voie parasternale droite (Figure 5A, Vidéo 1) ;
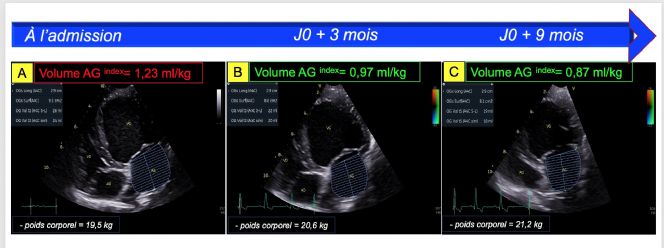
- La dilatation atriale gauche, avec un rapport atrium gauche/aorte en télédiastole augmenté égal à 1,58 (Figure 6A) ; (VU 1,2 chez le chien sain) et un volume atrial gauche télésystolique indexé au poids corporel, estimé par la méthode Simpson, augmenté et égal à 1,23 mL/kg (Figure 7A) ; (Valeur seuil 1,1 mL/kg en télésystole chez le chien sain) ;

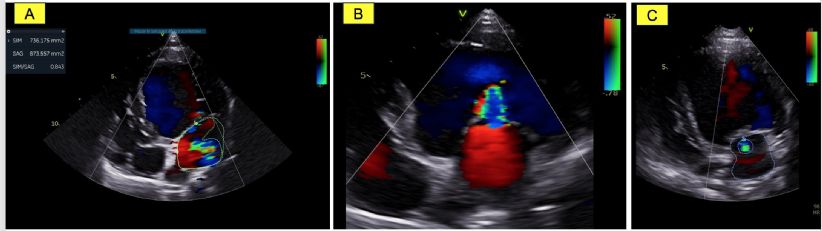
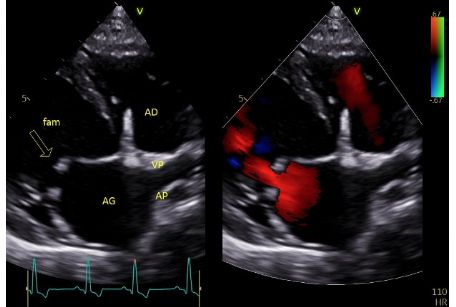
- La présence d'un reflux mitral holosystolique remplissant 84 % de la surface atriale gauche, à relier en partie à la dilatation de l'anneau mitral et expliquant le souffle systolique apexien gauche à l'auscultation cardiaque (Figure 8A, Vidéo 4A).
La dysplasie mitrale sténosante, présente les 4 principales caractéristiques échocardiographiques suivantes :
1. Des feuillets mitraux hyperéchogènes et épaissis de mobilité réduite (Figure 9) ayant pour conséquences l'association d'une insuffisance mitrale et d'une sténose mitrale modérée, cette dernière expliquant la composante diastolique du souffle à l'auscultation cardiaque (Figures 8A et 8B, Vidéo 5).
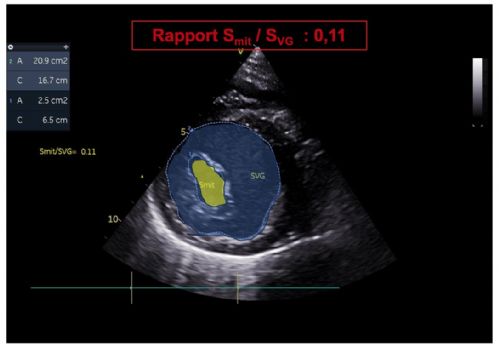
2. Une diminution du rapport de la surface de l'orifice mitral (Smit) sur la surface du ventricule gauche (SVG) en mésodiastole (Rapport Smit/SVG estimé entre 11 et 12 % selon les mesures ; VU chez le chien = 38 à 52 % selon O'Grady et coll., 1986) (Vidéo 6 et Figure 10).
3. Au mode Doppler pulsé, une inversion des ondes mitrales et une augmentation de la valeur de l'onde A mitrale (onde E = 1,03 m/s et une onde A = 1,49 m/s ; (VU chez le chien sain onde A 0,90 m/s ; Chetboul, 2018) (Figure 11).
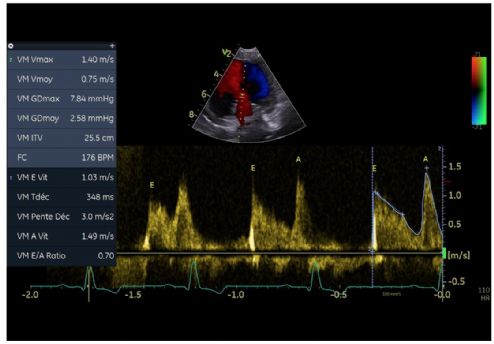
4. Une décroissance proto- et mésodiastolique lente de l'onde E avec un allongement du temps de demi-pression (T1/2mit) égale à 348 ms (VU 52 ms chez le chien sain selon Lehmkuhl et coll., 1994 ; Boon, 2011) (Figure 11).
En conclusion, l'examen échocardiographique a permis de mettre en évidence la coexistence d'une dysplasie mitrale sténosante congénitale expliquant la composante diastolique du souffle et d'un phénotype MCD occulte (c'est-à-dire compensé) caractérisé par une dysfonction systolo-diastolique majeure associée à une insuffisance mitrale d'extension colorimétrique importante, expliquant le souffle systolique apexien gauche de haut grade à l'auscultation. L'évolution cavitaire de la dysplasie mitrale sténosante ne peut expliquer ce phénotype MCD, il convient donc d'en rechercher l'origine.
Diagnostic
Diagnostic différentiel
Le phénotype MCD reconnaît des causes multiples3. Ces dernières s'articulent principalement autour de deux catégories distinctes. D'une part, la MCD primitive regroupant les formes génétiques, non génétiques et idiopathiques du phénotype, caractérisées par une dégénérescence du tissu musculaire cardiaque, indépendamment de toute affection systémique, qu'elle soit d'origine congénitale ou acquise. D'autre part, les myocardiopathies secondaires qui englobent un ensemble hétérogène de conditions, parmi lesquelles figurent notamment les causes suivantes3 :
1. Les myocardites infectieuses ou non infectieuses ;
2. Les dysendocrinies : hypothyroïdie et maladie d'Addison, notamment ;
3. Les myocardiopathies d'origine nutritionnelle (tauriprive, ou liée à une carence en L-Carnitine ou encore associée à un régime alimentaire « non traditionnel » (ex. : végétariens, sans céréales)) ;
4. Les tachyarythmies soutenues ;
5. Les myocardiopathies d'origine médicamenteuse ou toxique (ex : doxorubicine ; catécholamines) ;
Enfin, certaines cardiopathies pouvant « mimer » un phénotype MCD en raison de l'apparition d'une dysfonction systolique dans les stades évolués (la maladie valvulaire dégénérative mitrale (MVDM) et la persistance du canal artériel, par exemple).
Dans notre cas, considérant les antécédents alimentaires (consommation de croquettes sans céréales), une des hypothèses les plus probables est que cette hypocontractilité soit d'origine nutritionnelle. Des examens complémentaires sont néanmoins réalisés afin d'exclure une dysendocrinie et une carence en taurine.
Examens complémentaires
Un dosage des paramètres thyroïdiens (T4 totale, TSH) est réalisé afin d'évaluer la fonction thyroïdienne. La T4 totale et la TSH sont dans les normes, en défaveur d'une hypothyroïdie.
De plus, l'ionogramme permet de rendre peu probable une maladie d'Addison et le dosage de la taurine plasmatique une MCD tauriprive (Tableau 1).
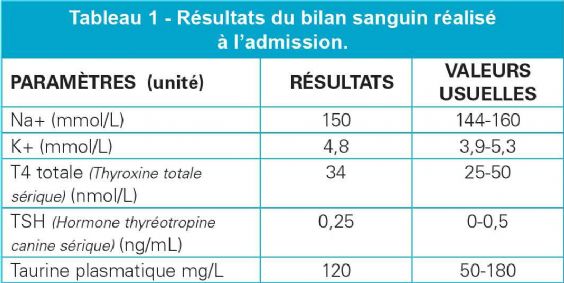
En conclusion, les résultats d'examens font suspecter en hypothèse principale une myocardiopathie d'origine nutritionnelle imputable au régime alimentaire « non traditionnel » (croquettes sans céréales) avec une taurinémie plasmatique dans les normes du laboratoire, sans pour autant exclure une carence en taurine dans le tissu myocardique.
Prise en charge
Diététique et thérapeutique
En raison de la forte suspicion de myocardiopathie nutritionnelle et du lien entre alimentation sans céréales et contractilité myocardique, un changement progressif du régime alimentaire est réalisé en faveur d'une alimentation à visée cardiaque avec des croquettes de la marque Pro Plan CardioCare. Considérant, l'âge, l'état sportif de l'animal, une quantité journalière de 300g/jour est conseillée, cette quantité apportant 2,1 g d'Oméga 3 et 600 mg de taurine. Cet aliment vétérinaire spécifique a comme particularité d'apporter également des précurseurs de la L-carnitine ainsi que des triglycérides à chaines moyennes, source d'énergie pour les cardiomyocytes.
La prise en charge thérapeutique de la dysplasie mitrale et de la dysfonction systolique a consisté en un traitement cardiaque avec du pimobendane (Vetmedin 5®) per os, pour son effet inotrope positif à la dose de 0,38 mg/kg/jour en deux prises quotidiennes. Un inhibiteur de l'enzyme de conversion de l'angiotensine (bénazépril (FORTEKOR F20 ®) à 0,5 mg/kg/jour en une prise quotidienne est également prescrit dans un second temps, au contrôle, 3 mois plus tard.
Évolution
Plusieurs contrôles cliniques et échocardiographiques sont réalisés à 3 mois, 6 mois, puis 9 mois. Au cours du suivi clinique, la propriétaire rapporte une bonne évolution de la transition alimentaire et une excellente appétence de la ration quotidienne du nouvel aliment. À neuf mois de suivi clinique, un tempérament plus vif est constaté avec une reprise progressive du poids. L'auscultation cardiaque révèle pour la première fois une FC normale (80 bpm en moyenne) et un SSAG, non piaulant, de grade moindre par comparaison avec J0, évalué à 3/6, avec toujours la persistance d'une prolongation diastolique.
Au cours des suivis échocardiographiques, plusieurs améliorations sont constatées dès 3 mois, les premières normalisations n'étant néanmoins constatées qu'au suivi de 9 mois. Elles sont représentées dans le Tableau 2, avec principalement :
- Une dysfonction systolique nettement améliorée avec une fraction d'éjection normalisée à J0 + 9 mois (Figures 2E et 2F, Tableau 2) malgré la persistance d'une hypokinésie radiale du septum interventriculaire qui contribue au maintien d'une fraction de raccourcissement diminuée mais de façon moindre (FR égale à 23 % à J0 +
9 mois versus 20% à J0+ 3 mois versus 6 % à J0 (Figures 1B, 1C et Tableau 2) ;
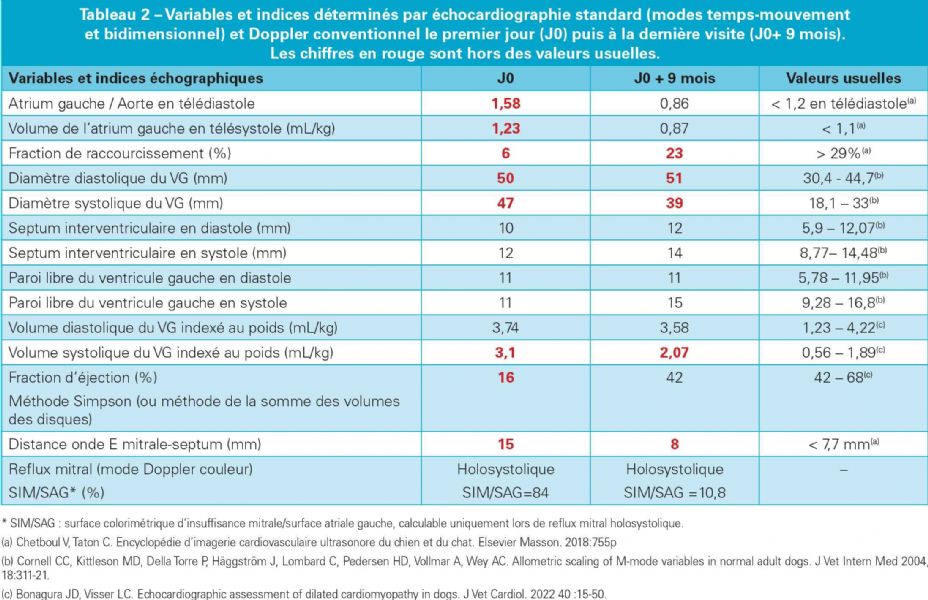
- Une diminution marquée en systole du volume et du diamètre ventriculaire gauche, lesquels restent néanmoins augmentés (Tableau 2 et Figures 1B et 1C versus 1A) ;
- Une réduction substantielle de la distance E-SIV par comparaison avec J0 (Figure 3B versus 3A) ;
- Une réduction progressive de l'espace inter-piliers au suivi de 3 mois et 9 mois par comparaison avec J0 (Figure 5B et 5C versus 5A, Vidéo 3 versus Vidéo 1) ;
- Une normalisation du diamètre atrial gauche en télédiastole (Figures 6C versus 6A) ainsi qu'une normalisation de son volume (Figures 7B et 7C versus 7A) ;
- Une réduction marquée de l'insuffisance mitrale en raison de la diminution de la taille de l'anneau mitral. Cette insuffisance mitrale occupant 10,8 % seulement de la surface atriale gauche en mode Doppler couleur et expliquant la diminution du grade du souffle cardiaque à l'auscultation (Vidéo 5 et Figure 8C versus 8A).
Discussion
Du point de vue clinique, ce cas revêt un intérêt particulier du fait de la découverte concomitante, chez un chien adulte de 4 ans, de deux affections cardiaques, à savoir une cardiopathie acquise (MCD secondaire) et une cardiopathie congénitale (dysplasie mitrale sténosante), toutes deux demeurant asymptomatiques. La seule manifestation clinique a été la détection d'un souffle cardiaque à l'auscultation. La réduction du grade du souffle cardiaque suite à la quasi-normalisation des diamètres ventriculaires gauches est en faveur de la coexistence à J0 d'une insuffisance mitrale à la fois fonctionnelle et lésionnelle.
D'un point de vue étiologique, la MCD est l'une des cardiopathies les plus fréquentes chez le chien adulte de grand format, avec un support génétique démontré dans certaines races4 (Terre neuve, Irish Wolfhound, groupe des Dogues, Boxer et Dobermann notamment). Des cas de MCD ont également été rapportés chez les chiens de type Pitbulls et apparentés, y compris l'American Staffordshire Terrier, comme dans le cas présent, mais ces races ne sont pas décrites comme particulièrement prédisposées à cette cardiopathie5. En effet, une étude rétrospective portant sur une cohorte de 369 chiens atteints de MCD, n'a révélé que 3 Staffordshire Bull Terriers6. De plus, une autre étude rétrospective consacrée à une cohorte de 189 chiens atteints de MCD n'en incluait aucune7.
En 2018, l'administration américaine en charge de la surveillance et de la sécurité des médicaments et des denrées alimentaires (United States Food and Drug Administration (FDA)) a publié un rapport préoccupant sur un potentiel lien entre des cas de MCD et certains régimes alimentaires émergents pour animaux de compagnie8. Les aliments à base de croquettes sans céréales y sont cités dans 91 % des cas, contenant dans 93 % des cas un certain type de légumineuses, principalement des pois ou des lentilles en quantité importante8. Parmi les 16 marques de croquettes sans céréales mentionnées dans ce rapport, la marque ACANA (la marque d'aliment que recevait le chien dans le cas présent) est la plus citée, apparaissant dans 67 des 431 rapports à l'époque8.
Suite à cette alerte de la FDA, un grand nombre de scientifiques se sont penchés sur cette affection cardiaque qui touche des chiens de races non associées à la MCD primaire9,10. Il est intéressant de noter que les chiens de type Pitbulls et race apparentées font souvent partie de ces races canines5,9,10. Dans une étude rétrospective portant sur une cohorte de 43 chiens, il a été constaté que 7% des chiens atteints de MCD et qui suivaient un régime sans céréales étaient de race Pitbull et apparentés10. De même, une autre étude prospective portant sur des chiens atteints de MCD a révélé que 6 des 51 chiens (soit 12%) atteints de MCD et qui suivaient un régime non traditionnel étaient de race Pitbull5. De plus, une sensibilité potentielle à la MCD associée aux croquettes sans céréales, ou du moins une tendance plus élevée à recevoir un régime qualifié de « non traditionnel » chez ces races, est évoquée dans une étude très récente de 20235.
Après avoir écarté les autres causes secondaires de MCD et considérant les antécédents alimentaires (un régime riche en légumineuses et sans céréales), l'hypothèse la plus probable chez ce chien est que l'hypocontractilité cardiaque soit d'origine nutritionnelle. Cette distinction entre une forme secondaire nutritionnelle et primaire a son importance, puisque la prise en charge précoce de cette forme secondaire est de bien meilleur pronostic, avec une réversibilité des lésions rapportée dans la littérature après changement du régime alimentaire en 3 à 9 mois, voire parfois 2 ans3,7,8,12. Ainsi, dans le cas présent, le choix de régime alimentaire s'est porté sur Pro Plan CardioCare (croquettes vétérinaires), contenant une combinaison de nutriments cardioprotecteurs associant des triglycérides à chaine moyenne, afin d'apporter une source d'énergie alternative aux cellules myocardiques, des acides gras longs anti-inflammatoires (EPA et DHA), des précurseurs de la L-carnitine (méthionine, lysine), de la taurine, du magnésium et de la vitamine E. Une étude pilote a suggéré de plus son impact potentiel sur la dilatation atriale chez le chien atteint de MVDM compensée (stade B ACVIM)13. Dans notre cas, le changement de régime alimentaire associé au traitement cardioprotecteur a entraîné une diminution du diamètre atrial et ventriculaire gauche dès le troisième mois. Des améliorations significatives de la majorité des paramètres échocardiographiques de la fonction systolique cardiaque ont été observées neuf mois après le diagnostic initial. Cependant, la fraction de raccourcissement est restée en dessous des valeurs usuelles, avec la persistance d'une hypokinésie du septum interventriculaire qu'il convient de continuer à surveiller. En effet, ces lésions pourraient être une séquelle myocardique irréversible, justifiant le maintien du traitement à visée cardiaque et des contrôles échocardiographiques réguliers.
Il est intéressant de noter que ce cas de réversibilité partielle de la MCD nutritionnelle est mentionné dans le dernier rapport de la FDA et semble être le cas de figure le plus courant chez ces animaux12. Dans ce rapport de la FDA, sur une cohorte de 121 chiens suivis, 107 présentaient différents stades de récupération. Environ 19 % des chiens (n = 23) ont complètement récupéré et près de 70 % (n = 84) ont présenté une récupération partielle avec une amélioration de la taille du ventricule gauche et/ou de la fonction systolique. 9 % des chiens (n = 11) n'ont montré aucune amélioration de la taille ou de la fonction du ventricule gauche et 7 d'entre eux sont décédés. Tous les chiens ayant complètement récupéré ont bénéficié d'un changement de régime alimentaire. Presque tous les chiens ont également été traités avec de la taurine et du pimobendane. Plus de la moitié des chiens ont également reçu un inhibiteur de l'enzyme de conversion de l'angiotensine, comme dans notre cas12.
Conclusion
Ce cas clinique de cardiologie/nutrition qui vous est présenté ici illustre bien l'importance de reconsidérer la question de la nutrition, non plus en tant que simple élément de conseil annexe, mais comme un levier d'action préventif, voire parfois thérapeutique, chez nos animaux domestiques.
Références bibliographiques
1. Bourguignon C, Caivano D, Dickson D, Vatne L, Harris J, Rishniw M, Pariaut R. Two-dimensional echocardiographic estimates of left ventricular volumes obtained in different views in dogs provide similar measurements but are not interchangeable. J Vet Cardiol. 2021;33:13-24.
2. Dukes-McEwan, Borgarelli, Tidholm, Vollmar, Ha?ggstro?m. Proposed Guidelines for the Diagnosis of Canine Idiopathic Dilated Cardiomyopathy. J Vet Cardiol. 2003:7-19.
3. Wendy A. Ware, John D. Bonagura Cardiovascular Disease in Companion Animals Dog, Cat and Horse, 2nd Edition, Chapitre 32 « Myocardial Diseases of the Dog » : (1282- 1347).
4. Dutton E, López-Alvarez J. An update on canine cardiomyopathies - is it all in the genes? J Small Anim Pract. 2018 Apr 17.
5. Fischer KE, Rush JE, Freeman LM. Pit bull-type breeds with dilated cardiomyopathy eating nontraditional diets improve after diet change (2015-2022). J Am Vet Med Assoc. 2023;261(7):1011-1019.
6. Martin MW, Stafford Johnson MJ, Celona B. Canine dilated cardiomyopathy: a retrospective study of signalment, presentation and clinical findings in 369 cases. J Small Anim Pract. 2009;50:23-29.
7. Tidholm A, Jönsson L. A retrospective study of canine dilated cardiomyopathy (189 cases). J Am Anim Hosp Assoc. 1997;3:544-550.
8. https://www.fda.gov/animal-veterinary/outbreaks-and-advisories/fda-investigation-potential-link-between-certain-diets-and-canine-dilated-cardiomyopathy (accès le 28 septembre 2023)
9. Walker AL, DeFrancesco TC, Bonagura JD, et al. Association of diet with clinical outcomes in dogs with dilated cardiomyopathy and congestive heart failure. J Vet Cardiol. 2022;40:99-109.
10. Freeman L, Rush J, Adin D, et al. Prospective study of dilated cardiomyopathy in dogs eating nontraditional or traditional diets and in dogs with subclinical cardiac abnormalities. J Vet Intern Med. 2022;36:451-463.
11. Walker AL, DeFrancesco TC, Bonagura JD, et al. Association of diet with clinical outcomes in dogs with dilated cardiomyopathy and congestive heart failure. J Vet Cardiol. 2022;40:99-109.
12. Jones J, Carey L, Palmer LA. « FDA update on dilated cardiomyopathy: fully and partially recovered cases », Scientific Forum Exploring Causes of Dilated Cardiomyopathy in Dogs. Manhattan, KS: Kansas State University; 2020.
13. Li Q, Heaney A, et al. Dietary intervention reduces left atrial enlargement in dogs with early preclinical myxomatous mitral valve disease: a blinded randomized controlled study in 36 dogs. BMC Veterinary Research. 2019; 15:425.