De quelles données dispose-t-on pour choisir un vaccin contre les affections respiratoires virales des bovins ?
Samedi 19 Avril 2025 Rurale 53022Séverine Boullier, Lionel Grisot, Brice Maytie, Christophe Hugnet, Jacqueline Bastien, Céline Lorteau, Yves Millemann
Membres du Comité de suivi du médicament vétérinaire de l'ANSES-ANMV*
Pour se protéger contre les agents pathogènes, deux réponses immunitaires adaptatives indépendantes existent dans l'organisme : la réponse immunitaire commune aux muqueuses (MALT) et la réponse immunitaire systémique. La réponse systémique est induite par la présence de l'antigène (Ag) dans l'organisme (tissus/sang...) alors que la réponse muqueuse est induite par la présence de l'Ag à la surface des muqueuses. Grâce à un contrôle strict de la circulation des lymphocytes, les cellules activées au niveau des muqueuses retournent dans les muqueuses et ne participent pas à la réponse systémique.
La réponse muqueuse est caractérisée par la synthèse d'immunoglobulines A (IgA). Ces anticorps (Ac) ont un fort pouvoir neutralisant tout en limitant l'inflammation, ce qui préserve l'intégrité des muqueuses. Une forte concentration en IgA spécifiques d'un agent pathogène au niveau des muqueuses est associée à une protection contre l'infection par ce dernier.
À l'inverse, la réponse humorale systémique se caractérise par la synthèse d'immunoglobulines G (IgG), qui sont des Ac permettant la destruction des agents pathogènes par des mécanismes inflammatoires (activation du complément, cytotoxicité...). Dans les conditions normales, les IgG sont très peu présentes au niveau des muqueuses. Les IgG sont également les Ac majoritaires dans le colostrum. Elles permettent la protection passive des nouveau-nés, indispensable pendant les premières semaines de vie, mais peuvent limiter l'efficacité de la vaccination. Les IgA, quant à elles, sont très peu présentes dans le colostrum.
Le système immunitaire du tractus respiratoire supérieur, appelé NALT pour « nasal associated lymphoid tissue », appartient au MALT (« Mucosa associated lymphoid tissue »). Il est très riche en sites inducteurs et permet l'activation d'effecteurs immunitaires qui vont circuler au niveau des différentes muqueuses de l'organisme et générer une réponse locale forte, y compris au niveau de la muqueuse respiratoire. La voie nasale est donc une voie très intéressante pour générer des réponses muqueuses.
Il est cependant très difficile d'induire une réponse immunitaire efficace au niveau du NALT, les Ags inertes étant éliminés par les mécanismes de défense non spécifiques avant d'avoir atteint les sites inducteurs. Actuellement, la totalité des vaccins immunogènes administrés par voie intra-nasale sont donc des vaccins vivants.
En élevage bovin allaitant et laitier, les agents pathogènes respiratoires peuvent représenter un fardeau sanitaire et économique important.1,2 Parmi ces agents pathogènes, deux virus, le BRSV (Virus Respiratoire Syncytial Bovin) et le BPI3 (Virus Parainfluenza 3 Bovin) ont des conséquences cliniques chez les jeunes bovins à la fois dans les élevages laitiers, les élevages allaitants et les ateliers d'engraissement.
Sur la base des vaccins disponibles en France aujourd'hui, plusieurs stratégies vaccinales sont possibles pour protéger les bovins des conséquences liées aux infections par les virus BRSV et BPI3.
De façon générale, il est considéré, et très généralement admis, que les vaccins vivants administrés par voie intra-nasale induisent une réponse locale au niveau de la muqueuse respiratoire et limitent ainsi la réplication virale précoce.
À l'inverse, les vaccins vivants et les vaccins inactivés injectables induisent une réponse systémique avec des Ac (IgG) capables de traverser la muqueuse respiratoire, uniquement quand celle-ci est inflammée.
L'objectif de cet article est de faire un bilan, à partir des données scientifiques disponibles sur les vaccins viraux commercialisés en France, des différentes stratégies vaccinales qui peuvent être mises en oeuvre par le praticien, en fonction de l'âge des animaux à protéger et du type d'élevage.
Méthodologie
Un bilan des données disponibles sur les vaccins bovins contenant les valences BRSV ou BPI3 a été réalisé. Pour cela, les moteurs de recherche PubMed, Scopus et Google scholar ont été utilisés, avec les mots clefs suivants : « cattle / calf-calves/beef / vaccine / BPI3 / BRSV / live - attenuated or inactivated - killed / monovalent or multivalent / nom du laboratoire fabricant / nom commercial du vaccin / immunity / immune response / prevention ». Les éléments complémentaires ont été obtenus, sur les sites web UPD de l'EMA et iRCP de l'ANMV (RCP, RPE et EPAR) et de la Pharmacopée européenne (monographies fixant notamment les niveaux d'efficacité attendus).3,4
À partir des articles disponibles, seules les données en lien avec les vaccins commercialisés en France ont été analysées. En effet, les vaccins disponibles dans d'autres pays (Amérique du Nord et Amérique du Sud) contiennent des souches vaccinales et des excipients qui peuvent être différents de ceux présents dans les vaccins européens.
Pour chaque étude, différents critères ont été évalués (Tableau « Bilan des publications disponibles »). Les articles ont été classés d'une part en fonction de la composition du vaccin (virus inactivé/vivant atténué) et de la voie d'administration (intra-nasale ou systémique) et d'autre part en fonction du type d'étude réalisée (expérimentale ou étude de terrain).
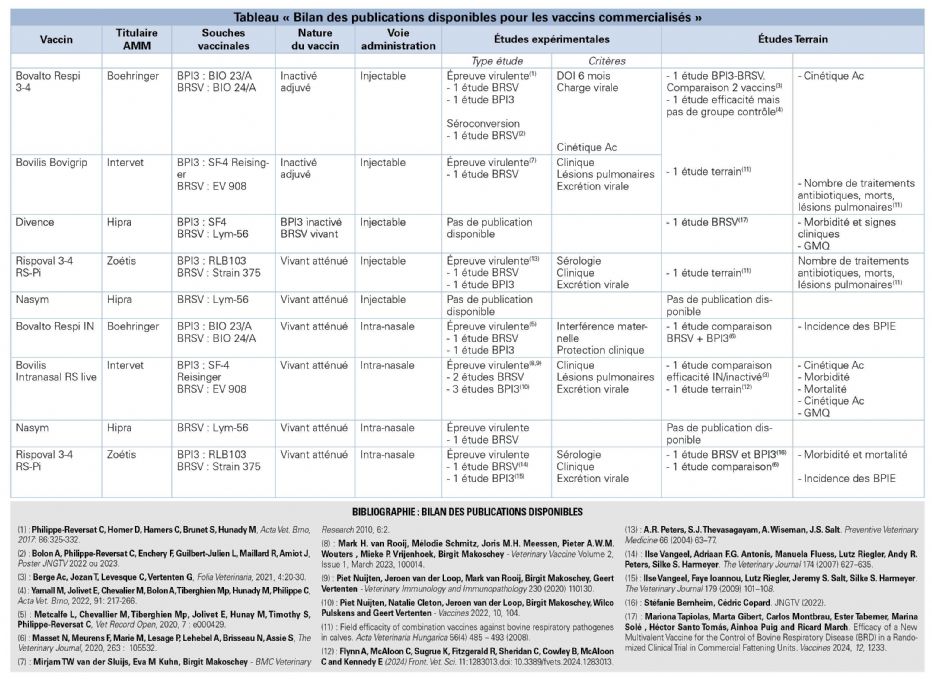
Bilan des données scientifiques disponibles
Données disponibles dans les RCP
Les vaccins cités ont été autorisés au cours des dernières décennies, l'Autorisation de mise sur le marché (AMM) la plus ancienne datant de 1988 (Tableau « Données des AMM »). Au fil du temps, les exigences réglementaires pour la délivrance d'une AMM se sont précisées, telles que type et niveau de protection conférée, mise en place et durée de l'immunité, possibles interférences sur la prise vaccinale (par ex. anticorps d'origine maternelle, interactions médicamenteuses). Un Résumé des caractéristiques du produit (RCP) a systématiquement été établi sur la base des exigences en vigueur. Plus récemment, des rapports publics d'évaluation ont été rédigés et mis en ligne, mais ne sont pas disponibles pour les produits les plus anciens.
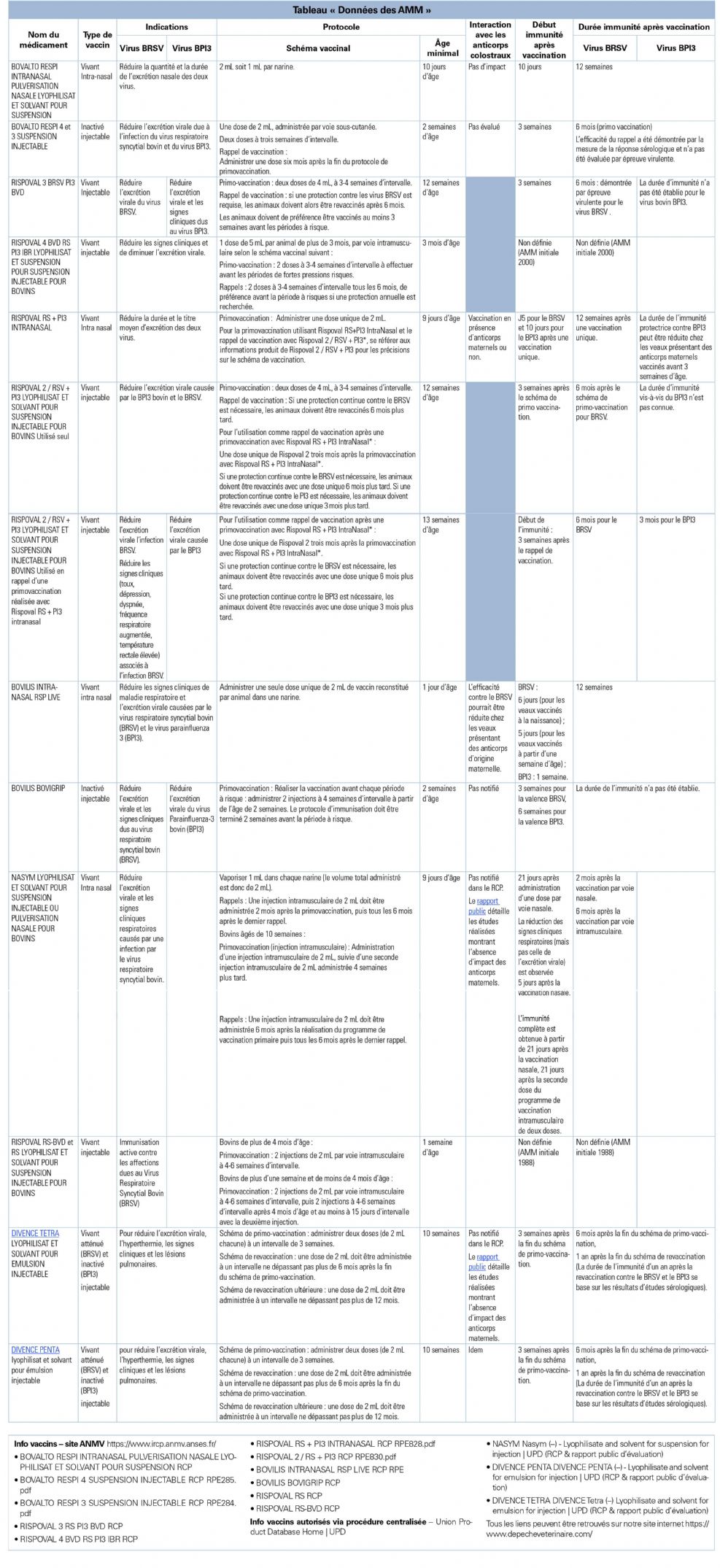
La délivrance d'AMM repose actuellement, entre autres, sur des études cliniques démontrant une protection significative d'animaux vaccinés par rapport à des animaux témoins face à une épreuve virulente contrôlée et/ou une épreuve sur le terrain. De plus, quand une monographie de la Pharmacopée européenne existe, elle fixe les niveaux de protection minimum requis. Les indications, mise en place et durée d'immunité sont établies d'après ces études.
Selon les vaccins, les rapports publics d'évaluation et les RCP donnent différents types d'indications, de la simple « immunisation active » à la « réduction des signes cliniques », pour une infection liée au virus BRSV, au virus BPI3 ou pour les deux virus. Aucun RCP de ces vaccins ne revendique la prévention de l'expression clinique de la maladie, ni la réduction ou la prévention de la contagiosité. Ces éléments devraient bien être précisés aux éleveurs lors de l'instauration d'un schéma vaccinal contre ces infections virales.
Les âges minimums d'administration varient entre le jour de la naissance et 12 semaines d'âge. Le délai de mise en place de l'immunité post-vaccinale n'est pas toujours notifié car non disponible. Lorsqu'il est validé, il est notifié. Il n'est notamment pas disponible pour les vaccins les plus anciens, puisque les éléments notifiés dans les RCP sont établis selon les données transmises par le laboratoire. Lorsqu'il est mentionné, ce délai de mise en place peut varier de 5 jours à 6 semaines. Les critères d'efficacité retenus pour l'évaluer correspondent à ceux de l'indication et peuvent donc être variables ; pour les vaccins viraux respiratoires, ils sont davantage fondés sur des réductions d'excrétion virale que sur des améliorations cliniques.
De même, la durée d'immunité n'est pas systématiquement notifiée dans les RCP. Elle est parfois indiquée comme n'étant pas connue. En fonction de l'agent viral ciblé, elle peut varier de 3 semaines à 6 mois. Cette durée d'immunité, quand elle a été évaluée, repose sur les mêmes paramètres que la mise en place de l'immunité ; parfois, comme indiqué alors dans le RCP, elle n'est établie que sur des données sérologiques.
Pour les vaccins destinés aux jeunes veaux, les interactions des anticorps maternels sur l'efficacité de la réponse vaccinale ne sont pas toujours étudiées. Il est parfois mentionné qu'en cas de présence d'anticorps maternels, « la planification de la primovaccination doit se faire en conséquence ». Pour d'autres vaccins, les RCP notifient l'absence d'interactions avec les anticorps maternels.
Pour les vaccins administrés par voie parentérale, les dates de rappel varient en fonction de l'agent pathogène considéré (3 mois ou 6 mois). La primo-vaccination nécessite, le plus souvent, deux injections.
Pour prolonger l'immunité des jeunes animaux, des rappels de vaccination sont parfois recommandés. Parmi ceux-ci, un seul schéma vaccinal couplé « intranasal puis injectable » (Rispoval RS + PI3 intranasalND à partir de 9 jours, puis Rispoval 2ND, 3 mois plus tard) est validé par le laboratoire, la durée d'immunité apportée est de 6 mois pour le virus BPI3 et de 9 mois pour le BRSV.5
Pour compléter les données indiquées dans les RCP, une analyse des données publiées a été réalisée selon les critères indiqués dans la méthodologie (cf. tableau « Bilan des publications disponibles »).
Données issues d'études publiées
Vaccins inactivés
En ce qui concerne les vaccins inactivés (toujours utilisés par voie injectable), trois publications fondées sur des études expérimentales sont disponibles : deux pour le BRSV et une pour le virus BPI3. Par ailleurs, seules deux publications relatent des études de terrain (concernant les deux valences BRSV et BPI3).
Dans les deux types d'études, les vaccins ont tous été testés sur des veaux âgés de moins d'un mois. Ces études montrent que les vaccins inactivés induisent une séroconversion pour les deux valences.
Pour le BRSV, la protection clinique semble limitée, mais une réduction de l'excrétion virale et des lésions pulmonaires a été observée après épreuve virulente. Dans la seule étude soumettant les animaux vaccinés à une épreuve virulente avec une souche BPI3, les résultats montrent une diminution de l'excrétion virale, mais il n'y a aucune donnée concernant la protection clinique.
Pour les deux études de terrain, l'efficacité clinique n'a pas pu être clairement démontrée en raison de la faible incidence des infections par le BRSV et le virus BPI3 pendant les périodes d'études dans les élevages concernés.
Il y a très peu de données disponibles sur la durée d'immunité conférée par ces vaccins. Ils semblent immunogènes pour 6 mois.
Vaccins vivants atténués injectables
Pour les vaccins vivants atténués utilisés par voie injectable, une seule publication est disponible. Elle relate une étude expérimentale réalisée sur des animaux de moins de 6 mois et concerne les deux valences virales, BRSV et BPI3. Les résultats indiquent une réduction de l'excrétion des deux virus chez les animaux vaccinés. Il n'y a pas de données sur la protection clinique éventuellement conférée. La durée d'immunité observée dans cette étude est de 6 mois pour le BPI3 et d'un an pour le BRSV.
La recherche bibliographique n'a pas permis d'identifier d'étude de terrain évaluant l'efficacité des vaccins vivants injectables.
Vaccins vivants atténués administrés par voie intranasale
Pour les vaccins vivants atténués utilisés par voie intranasale, neuf publications dédiées à des études expérimentales sont disponibles : cinq pour le BRSV et quatre pour le virus BPI3. Par ailleurs, trois publications relatent des études de terrain et concernent les deux valences BRSV et BPI3.
Les études expérimentales ont été réalisées sur de jeunes veaux, âgés de quelques jours à 3 semaines. Elles montrent une séroconversion précoce chez les animaux vaccinés, même en présence d'Ac maternels. Elles suggèrent par ailleurs une baisse de l'excrétion virale chez les veaux vaccinés. En revanche, la protection clinique conférée semble modeste, et variable selon les études. Il n'y a pas de publication disponible sur l'efficacité des vaccins administrés par voie intranasale sur des bovins en engraissement.
Pour les études de terrain, l'objectif principal était de comparer l'efficacité des vaccins administrés par voie intranasale par rapport aux vaccins inactivés injectables. La protection clinique apparaît décevante pour les deux types de vaccin et aucune différence d'efficacité n'a pu être établie dans ces études.
La très grande majorité des études, aussi bien expérimentales que de terrain, ont été réalisées sur des animaux très jeunes. Ces études ne mettent pas en évidence de différence nette d'efficacité entre les vaccins. La vaccination semble diminuer l'intensité et la durée d'excrétion des virus BPI3 et BRSV, mais ne semble pas conférer une protection clinique significative.
Les données de pharmacovigilance concernant les manques d'efficacité déclarés
Les déclarations de manque d'efficacité concernant les vaccins respiratoires bovins présents sur le marché en France sont relativement nombreuses (données ANMV de février 2019 à janvier 2023). Cependant, les investigations conduites ne concluent que très rarement à une défaillance réellement imputable au vaccin lui-même au regard de ses véritables objectifs, tels qu'ils sont indiqués dans les RCP de chaque spécialité vaccinale.
Applicabilité
Sur le terrain, quand un élevage est confronté à des atteintes respiratoires contagieuses récurrentes, le praticien est amené à prendre en compte de nombreux éléments lorsqu'il souhaite mettre en place un protocole vaccinal. Certains de ces éléments sont en lien direct avec le ou les agents pathogènes en cause : mise en évidence d'une circulation virale (par écouvillonnage, lavage broncho-alvéolaire ou aspiration transtrachéale ; sur un prélèvement nécropsique ; par des cinétiques de séroconversion ; ...). D'autres éléments, tout aussi importants sinon plus, prennent en considération la gestion et les pratiques d'élevage : type de production, effectifs et séparation éventuelle des lots d'animaux, introductions et achats plus ou moins réguliers d'animaux, mélanges d'animaux (allotement, pâturages collectifs, participation à des concours), type de logement, ambiance et ventilation des bâtiments, hygiène générale (bâtiments, alimentation, distribution du colostrum, buvée des veaux...), applicabilité réelle du protocole envisagé, disponibilité de la main-d'oeuvre, disponibilité et contention des animaux au moment des différentes injections vaccinales (notamment les rappels), coût du ou des vaccins, disponibilités et ruptures des vaccins.6
Très fréquemment, le choix du protocole vaccinal et son adaptation à chaque élevage relèvent d'un compromis entre un objectif optimal et les contraintes propres de cet élevage. Au quotidien, les praticiens font le constat de l'efficacité toute relative de la vaccination contre les agents pathogènes respiratoires viraux, si celle-ci n'est pas accompagnée de mesures de maîtrise adaptées au sein de l'élevage. Fréquemment, la complexité du plan de prévention réside plus dans la hiérarchisation de ces différentes mesures de maîtrise indispensables, que dans le choix du vaccin lui-même, de ses valences et de son type (vivant vs inactivé).
Les manifestations cliniques et leur âge d'apparition ont également une grande importance dans le choix opéré par le praticien pour tel ou tel protocole. Par exemple, des affections respiratoires contagieuses apparaissant au jeune âge conduisent à privilégier une voie d'administration intranasale dès le plus jeune âge d'un vaccin vivant atténué, lequel induirait une réponse immunitaire précoce et rapide au niveau de la muqueuse.7 De manière pragmatique, cette voie d'administration n'est utilisée que chez les jeunes animaux, la voie parentérale étant privilégiée chez les animaux plus âgés, en raison de sa facilité de réalisation. Pour la voie parentérale, le choix d'un vaccin vivant atténué ou inactivé reste difficile à faire au regard des quelques études comparatives disponibles. Une des questions majeures de l'immunité des animaux vis-à-vis des agents pathogènes respiratoires viraux est celle de l'immunité des jeunes animaux par transfert colostral. Le rôle protecteur de cette immunité passive est particulièrement important et son déficit peut être à l'origine de retentissements cliniques respiratoires considérables chez les veaux. Cependant, lors de vaccination par voie parentérale, la présence d'anticorps maternels peut entraver la mise en place d'une immunité active. Les études disponibles suggèrent que les vaccins vivants administrés par voie intranasale ne sont pas neutralisés par les Ac maternels, ce qui renforce l'intérêt de leur utilisation chez les très jeunes veaux.
Un point de vue généralement rencontré dans le monde vétérinaire est que les agents pathogènes viraux auraient très fréquemment un rôle essentiellement initiateur vis-à-vis des surinfections bactériennes par des pasteurellacées, dont l'action pathogène et les conséquences cliniques seraient beaucoup plus conséquentes et délétères.8 À l'échelle d'un élevage, et non de l'individu, la prévention de l'infection par ces virus pourrait ainsi rester tout à fait pertinente, de manière à éviter ou diminuer l'occurrence de ces surinfections bactériennes.9 La diminution des signes cliniques et/ou des lésions pulmonaires associées est un élément mis en avant dans les RCP de quelques vaccins. Ils peuvent être dans certains cas un des arguments décisionnels en faveur de la mise en place d'un protocole vaccinal au sein d'un plan de prévention général des maladies respiratoires contagieuses bovines.
Conclusion et perspectives
Les vaccins sont rarement comparés entre eux dans les études disponibles. Par ailleurs, chaque vaccin découle d'un développement spécifique et il n'y a pas d'harmonisation de leurs caractéristiques (âge à la vaccination, protection induite, mise en place et durée de l'immunité...). Il apparait donc difficile pour le praticien, au vu des données disponibles (RCP, rapports publics, études publiées, déclarations de pharmacovigilance), de sélectionner le vaccin le plus approprié et de définir la stratégie vaccinale adaptée au sein d'un élevage précis. Les vaccins sont maintenant développés au niveau européen, voire international, et par conséquent plus ou moins adaptés à une région ou un type d'élevage donné.
Des études complémentaires d'efficacité réalisées sur le terrain seraient nécessaires. En complément de la protection directe contre les infections par les pathogènes viraux, ces études devraient prendre en compte le poids économique de la vaccination en comparaison des coûts liés aux traitements (anti-inflammatoires et anti-microbiens lors des surinfections bactériennes). Il serait également judicieux d'analyser l'évolution des infections respiratoires dans les cheptels après plusieurs années de vaccinations en comparant les différentes stratégies vaccinales possibles (intranasales, injectables ou combinées). De plus, compte tenu de l'importance clinique et économique des infections respiratoires bactériennes, il serait important de générer également des données complémentaires sur l'efficacité terrain des vaccins anti-bactériens disponibles.
Enfin, même si les indications présentes dans les RCP (pas de revendication de protection clinique...) limitent l'analyse des déclarations de pharmacovigilance, ces déclarations restent indispensables pour évaluer l'efficacité sur le terrain des différents vaccins.
Au bilan, il apparait difficile de dégager des recommandations relatives à la vaccination contre les affections respiratoires virales des bovins, comme l'ont déjà souligné d'autres études.10 Une étude rétrospective récente montre que les vaccinations multivalentes (virus BoHV1, BPI3, BRSV, BVDV type 1 et 2) comprenant aussi des valences bactériennes (M. haemolytica et H. somni) semblent avoir un impact favorable significatif en termes de performances (GMQ, poids de carcasse, âge à l'abattage) et de recours aux antibiotiques sur des broutards exportés en Italie.11
Les mesures zootechniques, hygiéniques et préventives autres que vaccinales ne doivent pas être négligées dans la prévention du risque infectieux respiratoire transmissible chez les bovins10 avec la prise en compte non seulement des caractéristiques d'âge, de race, de modes d'élevage, mais aussi du devenir des animaux (reproducteurs, allotements, exportations).
Info vaccins - site ANMV https://www.ircp.anmv.anses.fr/
BOVALTO RESPI INTRANASAL PULVERISATION NASALE LYOPHILISAT ET SOLVANT POUR SUSPENSION RCPBOVALTO RESPI 4 SUSPENSION INJECTABLE RCP RPE285.pdfBOVALTO RESPI 3 SUSPENSION INJECTABLE RCP RPE284.pdfRISPOVAL 3 RS PI3 BVD RCPRISPOVAL 4 BVD RS PI3 IBR RCPRISPOVAL RS + PI3 INTRANASAL RCP RPE828.pdfRISPOVAL 2 / RS + PI3 RCP RPE830.pdfBOVILIS INTRANASAL RSP LIVE RCP RPEBOVILIS BOVIGRIP RCPRISPOVAL RS RCPRISPOVAL RS-BVD RCPInfo vaccins autorisés via procédure centralisée - Union Product Database Home | UPD
NASYM Nasym (--) - Lyophilisate and solvent for suspension for injection | UPD (RCP & rapport public d'évaluation)DIVENCE PENTA DIVENCE PENTA (--) - Lyophilisate and solvent for emulsion for injection | UPD (RCP & rapport public d'évaluation)DIVENCE TETRA DIVENCE Tetra (--) Lyophilisate and solvent for emulsion for injection | UPD (RCP & rapport public d'évaluation)Références bibliographiques
1. Murray GM et al., 2017 : GM Murray, SJ More, D. Sammin, MJ Casey, MC McElroy, RG O'Neill, WJ Byrne, B Earley, TA Clegg, H Ball, CJ Bell, JP Cassidy. Pathogens, patterns of pneumonia, and epidemiologic risk factors associated with respiratory disease in recently weaned cattle in Ireland. J Vet Diagn Invest. 2017;29:20-34. doi: 10.1177/1040638716674757
2. Oliveira VHS et al., 2020 : VHS Oliveira, AMD Agnol, JTT Fritzen, E Lorenzetti, AA Alfieri, AF Alfieri. Microbial diversity involved in the etiology of a bovine respiratory disease outbreak in a dairy calf rearing unit. Comp Immunol Microbiol Infect Dis. 2020;71:101494. doi: 10.1016/j.cimid.2020.101494
3. Pharmacopée Européenne : Monographie 07/2020:1176 - Vaccin vivant du virus parainfluenza bovin
4. Pharmacopée Européenne : Monographie 07/2020:1177 - Vaccin vivant du virus syncytial respiratoire bovin
5. Zoetis, 2024. Maladies respiratoires bovines : un nouveau protocole de vaccination. https://www.lepointveterinaire.fr/actualites/actualites-professionnelles/maladies-respiratoires-bovines-un-nouveau-protocole-de-vaccination.html#:~:text=Zoetis%20a%20ainsi%20d%C3%A9clar%C3%A9%20qu,de%20Rispoval%20IntraNasal%20en%20primo%2D
6. Maillard R et al., 2009 : R Maillard, G. Belbis, Y. Millemann. La visite d'élevage en pathologie respiratoire : étapes & La Visite « respiratoire » : replacer le bâtiment dans son contexte. Le Point Vétérinaire 40(spécial):15-20
7. Masset N et al., 2020 : N. Masset, S. Assie, V. Herry, G. Foucras, G. Meyer, R. Maillard, F. Schelcher. Choix des protocoles de vaccination pour les maladies respiratoires : comment choisir son vaccin ? protocoles selon les différents élevages ? Outils disponibles ? Recueil des JNGTV
8. Kamel MS et al., 2024 : MS Kamel, JL Davidson, MS Verma. Strategies for Bovine Respiratory Disease (BRD) Diagnosis and Prognosis: A Comprehensive Overview. Animals (Basel). 2024 Feb 16;14(4):627. doi: 10.3390/ani14040627
9. Vanbergue E et al., 2021 : É. Vanbergue, S. Assié, B. Mounaix, M. Guiadeur, A. Aupiais, F. Robert, D. Andrieu, O. Devloo, J. Quentin, N. Cebron, G. Meyer, A. Philibert, R. Maillard, G. Foucras. Intérêt de la vaccination dans le cadre de la préparation des jeunes bovins à l'entrée en atelier d'engraissement : résultats d'une étude française ». Bulletin des GTV, pages 67 à 76.
10. Yarnall M et al., 2024 : M Yarnall, F Amovilli, S Assié, J Bokma, M Pugh and D Werling. Identifying and addressing barriers and opportunities for bovine respiratory disease complex vaccination: a consensus paper on practical recommendations for best practise vaccination. Front. Vet. Sci. 11:1368060. doi: 10.3389/fvets.2024.1368060
11. Santinello M et al., 2024 : M Santinello, M De Marchi F Scali, V Lorenzi, C Romeo, GL Alborali , F Fusi, M Penasa. Effects of vaccination timing and target pathogens on performances and antimicrobial use in long-transported Charolais beef cattle from France to Italy - A retrospective study. Prev Vet Med. 2024 Mar;224:106130. doi: 10.1016/j.prevetmed.2024.106130. Epub 2024 Jan 25. PMID: 38335832.









